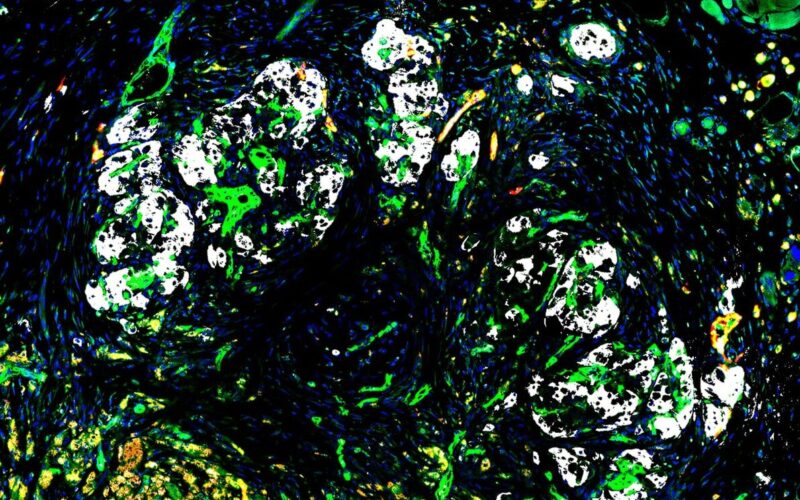
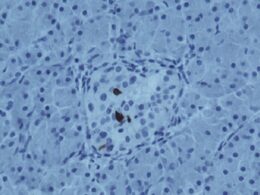
Οι νησίδες, που βρίσκονται στο πάγκρεας, είναι συστάδες από κύτταρα που εκκρίνουν ινσουλίνη και άλλα κύτταρα εμπλεκόμενα σε μικροσκοπικά, εξειδικευμένα αιμοφόρα αγγεία. Τα κύτταρα ινσουλίνης σκοτώνονται από μια αυτοάνοση διαδικασία στον διαβήτη τύπου 1, ο οποίος επηρεάζει περίπου εννέα εκατομμύρια ανθρώπους παγκοσμίως. Αν και η μεταμόσχευση νησίδων είναι μια πολλά υποσχόμενη προσέγγιση για τη θεραπεία τέτοιων περιπτώσεων, η μόνη μέθοδος που έχει εγκριθεί από το FDA μέχρι σήμερα έχει σημαντικούς περιορισμούς.
Σε μια μελέτη που δημοσιεύθηκε στις 29 Ιανουαρίου στο Science Advances, οι ερευνητές έδειξαν ότι ειδικά κύτταρα που σχηματίζουν αιμοφόρα αγγεία, που ονομάζονται «επαναπρογραμματισμένα αγγειακά ενδοθηλιακά κύτταρα» (R-VECs), μπορούν να ξεπεράσουν μερικούς από αυτούς τους περιορισμούς παρέχοντας ισχυρή υποστήριξη για νησίδες, επιτρέποντάς τους να επιβιώσουν και να αντιστρέψουν τον διαβήτη μακροπρόθεσμα όταν μεταμοσχεύονται κάτω από το δέρμα ποντικών.
«Αυτή η εργασία θέτει τα θεμέλια για τις υποδόριες μεταμοσχεύσεις νησίδων ως μια σχετικά ασφαλή και ανθεκτική επιλογή θεραπείας για τον διαβήτη τύπου 1», δήλωσε ο πρώτος συγγραφέας Δρ. Ge Li, μεταδιδακτορικός ερευνητικός συνεργάτης στο εργαστήριο του ανώτερου συγγραφέα Δρ. Shahin Rafii, διευθυντή του Ινστιτούτου Θεραπευτικής Αναγέννησης Οργάνων Hartman και του Ansary Stem Cell Medical division, καθηγητή Γενετικής Ιατρικής στο Weill Cornell Medicine και μέλος του Englander Institute for Precision Medicine και του Sandra and Edward Meyer Cancer Center στο Weill Cornell Medicine.
Η επί του παρόντος εγκεκριμένη μέθοδος μεταμόσχευσης νησίδων εγχέει νησίδες σε μια φλέβα στο ήπαρ. Αυτή η επεμβατική διαδικασία απαιτεί τη μακροχρόνια χρήση ανοσοκατασταλτικών φαρμάκων για την πρόληψη της απόρριψης νησίδων, περιλαμβάνει τη σχετικά ανεξέλεγκτη διασπορά των νησίδων και συνήθως καθίσταται αναποτελεσματική μέσα σε λίγα χρόνια, πιθανόν εν μέρει λόγω της έλλειψης κατάλληλων κυττάρων υποστήριξης. Στην ιδανική περίπτωση, οι ερευνητές θέλουν μια μέθοδο που εμφυτεύει νησίδες σε μια πιο ελεγχόμενη και προσβάσιμη περιοχή, όπως κάτω από το δέρμα, και επιτρέπει στον μεταμοσχευμένο ιστό να επιβιώσει επ’ αόριστον. Οι ερευνητές ελπίζουν επίσης ότι τελικά θα παρακάμψουν το πρόβλημα της απόρριψης του ανοσοποιητικού με τη χρήση νησίδων και ενδοθηλιακών κυττάρων που προέρχονται από κύτταρα των ίδιων των ασθενών ή είναι κατασκευασμένα ώστε να είναι αόρατα στο ανοσοποιητικό σύστημα.
Στη νέα μελέτη, οι Δρ. Li και Rafii και οι συνάδελφοί τους απέδειξαν τη σκοπιμότητα μακροχρόνιων υποδόριων μεταμοσχεύσεων νησίδων χρησιμοποιώντας R-VECs ως κρίσιμα κύτταρα υποστήριξης. «Δείξαμε ότι οι αγγειωμένες ανθρώπινες νησίδες εμφυτευμένες στον υποδόριο ιστό ποντικών που είχαν ανοσοανεπάρκεια συνδέθηκαν αμέσως με την κυκλοφορία του ξενιστή, παρέχοντας άμεση διατροφή και οξυγόνο, ενισχύοντας έτσι την επιβίωση και τη λειτουργία των ευάλωτων νησίδων», είπε ο Δρ Rafii. Πράγματι, που προέρχονται από ανθρώπινα κύτταρα ομφαλικής φλέβας, τα R-VECs είναι σχετικά ανθεκτικά σε συνθήκες μεταμόσχευσης –σε αντίθεση με τα εύθραυστα ενδοθηλιακά κύτταρα που βρίσκονται σε νησίδες– και είναι σχεδιασμένα ώστε να είναι εξαιρετικά προσαρμόσιμα, υποστηρίζοντας οποιονδήποτε συγκεκριμένο τύπο ιστού τα περιβάλλει.
«Είναι αξιοσημείωτο ότι διαπιστώσαμε ότι τα R-VECs προσαρμόστηκαν όταν συν-μεταμοσχεύτηκαν με νησίδες, υποστηρίζοντας τις νησίδες με ένα πλούσιο πλέγμα νέων αγγείων και ακόμη και παίρνοντας την «υπογραφή» της γονιδιακής δραστηριότητας των ενδοθηλιακών κυττάρων των φυσικών νησίδων», δήλωσε ο Δρ David Redmond, ο οποίος είναι επίκουρος καθηγητής υπολογιστικής βιολογίας στην ιατρική στο Hartman Organ Institute for Therap.
Η σημαντική πλειονότητα των διαβητικών ποντικών στα οποία μεταμοσχεύθηκαν νησίδες-συν-R-VECs ανέκτησαν φυσιολογικό σωματικό βάρος και έδειξαν φυσιολογικό έλεγχο της γλυκόζης του αίματος ακόμη και μετά από 20 εβδομάδες – μια περίοδος που για αυτό το μοντέλο διαβήτη ποντικού υποδηλώνει μια αποτελεσματική μόνιμη μεταμόσχευση νησίδων. Τα ποντίκια που έλαβαν νησίδες αλλά όχι R-VEC τα πήγαν πολύ λιγότερο καλά.
Η ομάδα έδειξε στη μελέτη ότι οι συνδυασμοί κυττάρων νησίδας και R-VEC μπορούν επίσης να αναπτυχθούν με επιτυχία σε μικρές «μικρορευστές» συσκευές – οι οποίες μπορούν να χρησιμοποιηθούν για την ταχεία δοκιμή πιθανών φαρμάκων για τον διαβήτη.
«Τελικά, η δυνατότητα χειρουργικής εμφύτευσης αυτών των αγγειωμένων νησίδων πρέπει να εξεταστεί για την ασφάλεια και την αποτελεσματικότητά τους σε μεγάλα ζωικά μοντέλα», δήλωσε η συν-συγγραφέας Δρ. Rebecca Craig-Schapiro, επίκουρη καθηγήτρια χειρουργικής στο Weill Cornell Medicine και χειρουργός μεταμοσχεύσεων στο NewYork-Weillne Medical Center. Η Δρ Craig-Schapiro συνδέεται επίσης με το Hartman Institute for Therapeutic Organ Regeneration στο Weill Cornell Medicine.
«Παρόλα αυτά, η μετάφραση αυτής της τεχνολογίας για τη θεραπεία ασθενών με διαβήτη τύπου 1 θα απαιτήσει την παράκαμψη πολλών εμποδίων, συμπεριλαμβανομένης της κλιμάκωσης επαρκούς αριθμού αγγειωμένων νησίδων και την επινόηση προσεγγίσεων για την αποφυγή ανοσοκαταστολής», είπε ο Δρ. Li. Αυτή η μελέτη είναι το πρώτο βήμα για επιτύχει αυτούς τους στόχους, οι οποίοι θα μπορούσαν να είναι εφικτές τα επόμενα χρόνια.